I lipidi sono molecole organiche (biomolecole) che pure differenziandosi in diversi gruppi, hanno in comune la caratteristica di essere insolubili in acqua. Vengono distinte 8 classi: acidi grassi-glicerolipidi-glicerofosfolipidi-sfingolipidi-saccarolipidi-polichetidi-steroli-prenoli.
Gli acidi grassi sono degli acidi carbossilici, cioè formati da una lunga catena lineare idrocarburica idrofobica insolubile in acqua con all’estremità un gruppo carbossilico OCH=O (caratteristico degli acidi grassi in quanto è l’unico gruppo polare). Grazie proprio a questa loro caratteristica, tendono, in soluzioni acquose, a formare delle MICELLE, strutture sferiche con un guscio idrofilo ed un cuore lipofilo.
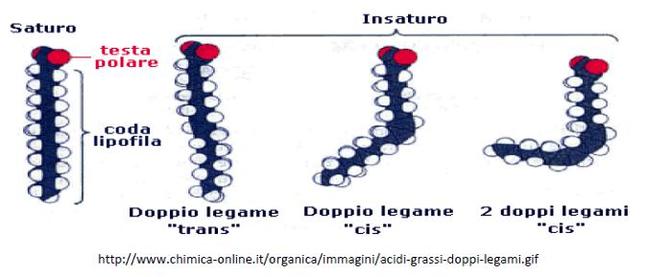
Vengono classificati in base al numero di atomi di carbonio ed alla presenza o meno di doppi legami.
Dal punto di vista strutturale la lunghezza della catena di carbonio può variare da 14-36 atomi di carbonio, classificandoli perciò in:
In base alla presenza di doppi legami si classificano in:
La presenza di questo doppio legame può conferire alle molecole l’isomeria CIS, se i 2 atomi di idrogeno legati ai carboni impegnati nel doppio legame sono disposti sullo stesso piano, TRANS se la disposizione spaziale è opposta. La configurazione CIS abbassa il punto di fusione dell’acido grasso e ne fa aumentare la fluidità.
Dal punto di vista funzionale gli acidi grassi svolgono un ruolo:
Energetico in quanto durante l’attività a bassa intensità, l’energia è fornita principalmente dal metabolismo lipidico con conseguente liberazione di acidi grassi dai triacilgliceroli del tessuto adiposo, mentre i trigliceridi intramuscolari ed il glicogeno non contribuiscono in maniera significativa alla produzione energetica durante una attività di endurance. Gli acidi grassi vengono dopo di che trasportati nel circolo sanguigno legati ad una proteina, l’albumina, e vengono poi rilasciati nei muscoli dove costituiscono il sub-strato per i processi ossidativi.
La massima attivazione del metabolismo degli acidi grassi viene raggiunta mediamente dopo 20-30 minuti dall’inizio dell’esercizio fisico. Questo perché inizialmente vengono utilizzati prima gli acidi grassi ematici e solo quando il loro livello diminuisce aumenta la lipolisi del tessuto adiposo. Svolgono anche una funzione di deposito di riserva energetica, in quanto se non utilizzati vengono esterificati (viene fatto reagire un acido con un alcool) in triacilglicerolo.
Il glicerolo infatti è un alcool trivalente costituito da una catena di 3 atomi di carbonio a cui si legano tre acidi grassi tramite un legame estere. In questa forma viene depositato sia a livello muscolare che nel tessuto adiposo all’interno degli adipociti. Il vantaggio significativo di usare i triacilglicerolo sta nel fatto che per prima cosa gli atomi di carbonio degli acidi grassi sono più ridotti rispetto ai polisaccaridi, ma la loro ossidazione rende una quantità di energia maggiore; in secondo luogo, poiché i triacilgliceroli sono idrofobici e quindi non idratati, gli organismi che conservano energia sotto forma di grassi non devono trasportare un peso extra di acqua di idratazione.
Infine svolgono una funzione da isolamento termico e componente strutturale della pelle, che permette l’integrità della cute stessa e contribuisce alla termoregolazione.
Il tessuto adiposo è costituito da cellule chiamate adipociti che sono in grado di accumulare lipidi sotto forma di trigliceridi e di liberarli come acidi grassi e glicerolo. Pertanto, visto che i grassi vengono utilizzati soprattutto per produrre energia, il tessuto adiposo costituisce una vera e propria riserva di energia.
L’energia prodotta dal tessuto adiposo viene utilizzata per il metabolismo basale (ovvero i processi necessari all’organismo per attività vitali, come quella cardiaca e respiratoria) nel 70% dei casi, nel restante 30% in processi facoltativi come l’attività sportiva. Considerato a lungo come un tessuto metabolicamente inerte la cui funzione era soltanto l'accumulo di grasso sotto forma di trigliceridi, attualmente il tessuto adiposo è ritenuto un tessuto funzionalmente attivo, le cui cellule intervengono direttamente nella sintesi, accumulo e liberazione dei trigliceridi, e sono in grado di produrre ormoni, tra cui la LEPTINA e l’ADIPONECTINA, che influenzano l'attività dell'intero organismo. Nei mammiferi si distinguono due tipi di tessuto adiposo, che differiscono per il colore (quando osservati a fresco), i caratteri citologici, la distribuzione e l'attività funzionale: tessuto adiposo bruno e tessuto adiposo bianco.

È l’unità morfologica fondamentale che compone il tessuto adiposo, ha un diametro tra i 20 e i 200μm che può aumentare anche di 20 volte, mentre il volume può aumentare di migliaia di volte in seguito ad una accentuata sollecitazione nutrizionale.
In condizioni normali hanno una forma rotondeggiante con volume intracellulare occupato per il 90% da un’unica grossa goccia lipidica. Il nucleo e i pochi mitocondri sono “schiacciati” contro la membrana plasmatica. In condizione di digiuno la cellula diventa molto più piccola con numerose goccioline lipidiche e molte micro-invaginazioni della membrana plasmatica; la morfologia degli adipociti nel digiuno è molto simile a quella dei pre-adipociti. Gli adipociti sono raccolti in lobuli tenuti insieme da un trama di tessuto connettivale.
Il tessuto adiposo bianco è abbondante a livello sottocutaneo, attorno ai reni, nei mesenteri, nel midollo osseo giallo, nelle regioni retroperitoneali, ascellari ed inguinali.
Ha principalmente una funzione di: 1) riserva energetica (sintetizza ed immagazzina trigliceridi a partire da acidi grassi, lipoproteine e glucosio); 2) idrolizzare i trigliceridi accumulati e li riversa nel sangue (come acidi grassi liberi) per soddisfare le richieste energetiche; ha una funzione di isolante termico; 3) funziona da ammortizzatore meccanico in zone particolarmente sottoposte a pressione (es. piante del piede); 4) produce ormoni e sostanze biologicamente attive.
A fresco questo tessuto presenta una colorazione bianca o giallastra a seconda della quantità dei pigmenti liposolubili presenti. È poco vascolarizzato ed è formato da adipociti molto grandi, di diametro superiore a 100 μm. La maggior parte del volume cellulare è occupato da un'unica goccia lipidica non circondata da membrana, che sospinge il nucleo alla periferia della cellula riducendo il citoplasma ad un sottile anello periferico.
Nella porzione extracellulare del tessuto adiposo, attaccato alla superficie dell’endotelio, è presente l’enzima lipoproteina lipasi. Tale enzima ha il compito di idrolizzare il triacilglicerolo in acidi grassi e glicerolo, che successivamente entreranno all’interno del tessuto adiposo, dove verranno riesterificati a triacilglicerolo per esser conservati negli adipociti.
Il tessuto adiposo bruno è presente solamente nei mammiferi: nella specie umana è abbondante soprattutto durante la vita fetale e neonatale, mentre nell’adulto resta in piccole tracce. Generalmente nell’organismo è localizzato nella regione interscapolare, ascellare, lungo i grossi vasi sanguigni e attorno a rene e surrene.
A fresco questo tessuto ha una colorazione scura, dovuta alla ricca vascolarizzazione ed alla presenza di citocromi nei numerosi e grandi mitocondri. Gli adipociti bruni sono di dimensioni inferiori rispetto agli adipociti bianchi, in sezione appaiono poligonali. All'interno dell'adipocita bruno i lipidi sono distribuiti in numerose goccioline non avvolte da membrana ma libere nel citoplasma, di conseguenza il nucleo è in posizione centrale ed il citoplasma (più abbondante che nell'adipocita bianco) non è sospinto alla periferia della cellula. Rispetto al tessuto adiposo bianco possiede maggiore vascolarizzazione ed innervazione. Secondo studi recenti, è possibile la trasformazione degli adipociti bruni in adipociti bianchi (per unione delle gocciole lipidiche) e viceversa, a seconda della necessità metaboliche dell'organismo.
Negli adipociti bianchi l'idrolisi dei trigliceridi avviene in base alle richieste energetiche dell'organismo, mentre in quelli bruni avviene in risposta ad un abbassamento della temperatura corporea (ipotermia): negli animali ibernanti, quando la temperatura si abbassa troppo o al momento del risveglio, gli adipociti bruni producono energia sotto forma di calore che innalzano la temperatura del sangue, determinando così un rapido aumento della temperatura corporea (termogenesi); negli organismi non ibernanti il tessuto adiposo bruno si attiverebbe in caso di eccessivo introito calorico alimentare (termogenesi post-prandiale), e quando questi organismi restano esposti per lungo tempo ad ambiente freddo si avrebbe la trasformazioni degli adipociti bianchi in adipociti bruni, al fine di mantenere stabile il bilancio energetico corporeo.

Tessuto adiposo bianco. È formato da adipociti molto grandi, di diametro superiore a 100 μm. La maggior parte del volume cellulare è occupato da un'unica goccia lipidica non circondata da membrana, che sospinge il nucleo alla periferia della cellula, riducendo il citoplasma ad un sottile anello periferico.
Tessuto adiposo bruno. Gli adipociti bruni sono di dimensioni inferiori rispetto agli adipociti bianchi e in sezione appaiono poligonali. All'interno dell’adipocita, i lipidi sono distribuiti in numerose goccioline non avvolte da membrana ma libere nel citoplasma; di conseguenza il nucleo è in posizione centrale ed il citoplasma (più abbondante che nell’adipocita bianco) non è sospinto alla periferia della cellula. Il tessuto adiposo bruno è diviso in lobuli da sottili setti di tessuto connettivo.
Per quanto riguarda il metabolismo degli acidi grassi in condizione di riposo, si può distinguere un metabolismo esogeno, cioè l’insieme di tutti quei passaggi che servono ad assimilare i lipidi attraverso la dieta, ed un metabolismo endogeno, che riguarda tutti quei passaggi di mobilizzazione, sintesi e stoccaggio dei lipidi sintetizzati dall’organismo.
La maggior parte dei lipidi introdotti con dieta è costituita da triacilgliceroli (TAG). I lipidi per essere assorbiti dalla parete intestinale devono essere emulsionati durante peristalsi intestinale, al fine di scindere le molecole lipidiche in molecole più piccole e quindi più facilmente “attaccabili” dagli enzimi che serviranno a digerirli.
Grazie all’azione emulsionante dei sali biliari (agente anfipatico che lega la sua parte polare alle molecole d’acqua e la parte apolare ai grassi) che legano tra loro, si formano delle micelle miste composte da sali biliari e triacilglicerolo.
A questo punto interviene l’enzima colipasi, (enzima riversato in forma inattiva dal pancreas) che legandosi alle micelle induce un cambiamento conformazionale, rendendo così possibile l’azione della lipasi, che finalmente può agire (1 TAG=2Acidi grassi-2MAG) spezzando un solo legame di acido grasso alla volta; dopo di che queste micelle migrano verso la superficie dell’enterocita, dove riversano il contenuto secondo trasporto facilitato passivo.
All’interno dell’enterocita i prodotti della degradazione, avendo scarsa mobilità in un ambiente acquoso in quanto idrofobici, vengono riconvertiti in triacilglicerolo ed impacchettati insieme al colesterolo ed a specifiche proteine, formando degli aggregati lipoproteici di trasporto detti Chilomicroni. Gli acidi grassi più piccoli rilasciati dagli enterociti entrano direttamente nel torrente circolatorio ematico legandosi ad una specifica proteina, l’Albumina.
I chilomicroni sono delle lipoproteine di trasporto rivestite esternamente da uno strato di fosfolipidi con le teste polari verso l esterno. I trigliceridi sono raggruppati verso l'interno e rappresentano più dell'80% della massa della particella. Sempre sulla superficie sporgono diverse apolipoproteine (B-48, C-III, C-II) che agiscono come segnali per la captazione dei chilomicroni e per il metabolismo del loro contenuto.
I chilomicroni che contengono l’apolipoproteina C-II vengono trasferiti dalla mucosa intestinale al sistema linfatico ed attraverso la vena succlavia al sangue, trasportandoli ai muscoli scheletrici, al tessuto adiposo e al cuore.
Nella porzione extracellulare dei capillari di questi tessuti, (muscolo scheletrico, cuore, tessuto adiposo, ghiandola mammaria) attaccato alla superficie dell’endotelio, è presente l’enzima lipoproteina lipasi, che viene attivato grazie all’APO C-II di cui il chilomicrone è dotato. Tale enzima idrolizza i triacilglicerolo in acidi grassi e glicerolo che entreranno all’interno delle cellule bersaglio e, nel muscolo, gli acidi grassi andranno ad essere ossidati per produrre energia, nel tessuto adiposo invece, verranno riesterificati a triacilglicerolo per esser conservati negli adipociti. Di conseguenza all’interno dell’adipocita troviamo l’enzima triaciglicerolo lipasi, definito anche lipasi ormone-sensibile (adrenalina-noradrenalina) che inizia la lipolisi per il rilascio degli acidi grassi nel sangue.
I chilomicroni svuotati (cioè dai quali sono stati rimossi quasi completamente i triacilglicerolima contengono ancora colesterolo e apolipoproteine) prenderanno il nome di chilomicroni remnant e verranno captati dal fegato tramite un meccanismo recettoriale mediato dall’APO-E. All’interno del fegato il chilomicroni rilasceranno colesterolo e verranno degradati dai lisosomi.
Sulla membrana delle cellule muscolari è presente una specifica proteina trasportatrice CD36, in grado di interagire con l’acido grasso, trasportandolo nell’ambiente intracellulare (gli acidi grassi a catena corta non hanno bisogno di interagire con la CD36 in quanto le loro dimensioni gli consentono di solubilizzarsi con la membrana biologica e attraversarla). Una volta all’interno, visto che ci sarà un ambiente idrofilico, l’acido grasso sarà stabilizzato grazie all’interazione con una proteina FABP, la quale la veicolerà l’acido grasso verso il mitocondrio, nel quale subirà delle modificazioni per penetrarvi all’interno (b-ossidazione).
Il 95% dell’energia ricavabile dai triacilgliceroli deriva dagli acidi grassi, mentre il restante 5% dal glicerolo, il quale, una volta all’interno della cellula muscolare, subisce una serie di modificazioni che gli permetteranno di entrare direttamente alla V reazione glicolitica. Prevalentemente però il glicerolo liberato va al fegato.
Ha inizio nel fegato, il quale è capace di riciclare le strutture rimanenti dei chilomicroni (ma non solo) per risintetizzare acidi grassi per i tessuti. È rappresentato dall’insieme di quelle reazioni che caratterizzano i lipidi prodotti dall’organismo. L’eccesso di acidi grassi viene convertito in triacilglicerolo, che legandosi alle lipoproteine può essere trasportato nel torrente ematico. Il trasporto dei lipidi endogeni nel torrente ematico e linfatico è garantito da altre tipologie di lipoproteine prodotte dal fegato: VLDL-LDL-HDL.
Le VLDL (very low density lipoproteine) 70% trigliceridi, 20% colesterolo, 10% proteine.
Le VLDL hanno il compito di trasportare triacilglicerolo al tessuto muscolare e tessuto adiposo. Quando la dieta contiene più acidi grassi di quanti siano immediatamente necessari, essi vengono convertiti in triacilglicerolo nel fegato e si legano alle lipoproteine VLDL. Appena messe in circolo queste lipoproteine non sono ancora mature e sono formate da molto triacilglicerolo e poco colesterolo. Entrando a contatto con le HDL ricevono da esse APOC-II e APO-E, raggiungendo così la maturità. A questo punto le VLDV vengono trasportate al tessuto muscolare e al tessuto adiposo, dove grazie all’APOC-II viene attivata la lipoproteina lipasi, determinando il rilascio di acidi grassi e glicerolo a partire dai triacilgliceroli contenuti nella stessa VLDL. Svuotata dai triacilgliceroli la VLDL diventa IDL (forma di passaggio tra VLDL e LDL) perdendo APOC-II. Il 50% di queste IDL viene assorbito dagli epatociti grazie all’interazione con APO-E presente sulla superficie delle IDL, il restante 50% perde ulteriori triacilgliceroli e diventa LDL.
Le LDL (low density lipoproteine) 20% trigliceridi, 55% colesterolo, 25 proteine.
Sono proteine molto più ricche di colesterolo ed esteri del colesterolo. La loro apolipoproteina principale è l’APOB-100. Il ruolo delle LDL è quello di trasportare principalmente colesterolo ai tessuti periferici che possiedono uno specifico recettore per l’APOB-100. Il legame APOB-100-RECETTORE innesca un processo di endocitosi che andrà ad inglobare l’LDL più il recettore, trasferendoli all’interno della cellula. Il fenomeno di endocitosi è mediato da una proteina posta sotto la membrana cellulare: essa prende il nome di Clatrina, la quale attira i recettori legati all’LDL in un punto specifico della superficie della cellula, creando una invaginazione verso l’interno della membrana che porterà alla formazione della vescicola (endosoma). La vescicola creata si fonderà con un lisosoma (fagosoma) contenente enzimi in grado di idrolizzare l’LDL e rilasciare nel citosol colesterolo, acidi grassi e amminoacidi. Il colesterolo liberato verrà immagazzinato sotto forma di piccole gocce.
Le HDL (higt density lipoproteine) 15% trigliceridi, 35% colesterolo, 50% proteine hanno origine nel fegato e nell’intestino tenue, inizialmente contengono molte proteine e quantità limitate di colesterolo. Le apolipoproteine contenute sono APO-A1, APO-A4, APO-C1, APO-C2 ricevute dalle VLDL e APO-C3, APO-D, APO-4 ricevute da LDL. La funzione delle HDL è quella di captare il colesterolo in eccesso, presente nei tessuti extraepatici, e trasformarlo in colesterolo esterificato mediante uno specifico enzima localizzato sulla loro superficie, che prende in nome di Lectina-colesterolo aciltransferasi.
Questo enzima esterifica il colesterolo utilizzando la lectina. A questo punto il colesterolo esterificato entra all’interno delle HDL per essere convogliato nel fegato dove le HDL, grazie all’APO-E, possono interagire con specifici recettori degli epatocidi che mediano l’endocitosi; oppure possono interagire con un recettore SR-BI, che non media l’endocitosi, ma permette il trasferimento del colesterolo da HDL a tessuto. L’HDL svuotata si dissocia dal recettore per tornare in circolo, per estrarre lipidi da chilomicroni e VLDL o colesterolo da tessuti extraepatici. In particolar modo l’HDL vuota può prelevare il colesterolo presente in un tessuto grazie all’interazione con il recettore SR-BI.
Durante esercizi ad intensità sia lieve che moderata [25 – 65% (VO2max)] è associato un aumento di circa 5–10 volte dell’ossidazione grassa a causa dell’aumento delle richieste energetiche muscolari.
Una grande porzione del rifornimento degli acidi grassi è fornita dalla lipolisi dei trigliceridi del tessuto adiposo, che aumenta di 2–3 volte a causa di una maggiore stimolazione dei recettori β-adrenergici.
Inoltre, la percentuale di acidi grassi rilasciati che sono riesterificati diminuisce della metà, presumibilmente a causa delle alterazioni del flusso sanguigno che agevola la consegna degli acidi grassi dal tessuto adiposo al muscolo sotto sforzo.
Infatti esercizi ad intensità moderata hanno la peculiarità di raddoppiare il flusso sanguigno nel tessuto adiposo, e di aumentarlo più di dieci volte nel tessuto muscolare scheletrico.
Risulta interessante analizzare lo studio “Lipid metabolism during endurance exercise” in quanto i grassi provenienti dalla lipolisi del tessuto adiposo non sono gli unici ad essere ossidati. Il rapporto tra la lipolisi, l’assorbimento da parte del tessuto di acidi grassi plasmatici [tasso di scomparsa dell’acido grasso dal plasma (Rd)] e l’ossidazione degli acidi grassi a riposo e durante l'esercizio prolungato di moderata intensità (45% di VO2max) è mostrato in figura:

Tassi di lipolisi (3 × il tasso di glicerolo di comparsa nel plasma), l'assorbimento dell'acido grasso e di ossidazione degli acidi grassi a riposo e durante 4h di esercizio su pedana mobile eseguita al 45% (VO2max) in soggetti non allenati. Durante i primi 120 minuti di esercizio il tasso lipolitico è circa due volte il tasso di ossidazione dell'acido grasso, tuttavia l'assorbimento di acidi grassi plasmatici (acido grasso Rd) è simile al tasso di ossidazione dei grassi durante questo periodo.
Infatti, parecchi ricercatori hanno riferito che l'acido grasso Rd è inferiore all’ossidazione degli acidi grassi durante le prime 1-2 h di esercizio.
Questa prova suggerisce l’esistenza di un'altra fonte energetica, presumibilmente o dal plasma o dai triacilgliceroli intramuscolari (IMTGs), che viene mobilizzata ed ossidata oltre al contributo dei NEFA (acidi grassi provenienti dal tessuto adiposo).
La lipolisi dei trigliceridi del tessuto adiposo, l'assorbimento di acido grasso del plasma e l’ossidazione degli acidi grassi aumentano progressivamente nel corso di un esercizio.
Dopo 2h di esercizio, il tasso di assorbimento dell'acido grasso del plasma diventa superiore alla velocità di ossidazione degli acidi grassi, che suggerisce che gli acidi grassi rilasciati nel plasma dal tessuto adiposo siano in grado di fornire tutti gli acidi grassi utilizzati da muscoli sotto sforzo.
Così all’aumentare di durata di un esercizio, è probabile che il contributo relativo dell’IMTG declini rispetto all’ossidazione grassa totale, e il contributo da acido grasso dal plasma aumenta.
Questo schema suggerisce perciò che gli l’IMTGs rappresentino una porzione considerevole dei grassi totali utilizzati negli sport di resistenza durante le prime 2 ore, fornendo circa il 50% del totale di grassi ossidati durante l'esercizio.